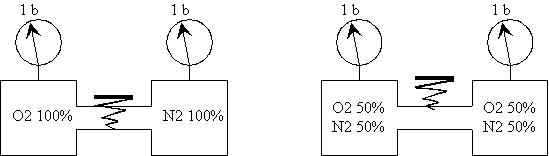SOMMAIRE
0. Introduction *
1. Toxicité des gaz
*
1.1. Rappels *
1.2. Expériences *
1.3. Enoncé de la loi de Dalton *
1.4. Applications *
1.5. Conséquences *
1.6. Exercices *
2. Dissolution des gaz *
2.1. Rappels *
2.2. Expérience *
2.3. Enoncé de la loi de Henry *
2.4. Application à la plongée *
2.5. Conséquences *
3. Notions d’optique *
3.1. Introduction *
3.2. Réflexion et Réfraction *
3.3. Absorption *
3.4. Diffusion *
4. Notions d’acoustique *
4.1. Introduction *
4.2. Définitions *
4.3. Vitesse du son *
4.4. Applications *
5. Conclusion *
Introduction
Cet exposé est le complément de la première
présentation de physique. Après avoir considéré
les aspects de pression, de compressibilité des gaz et de flottabilité,
nous poursuivrons ici notre tour d’horizon des grandeurs, phénomènes
et mécanismes physiques mis en jeu par la plongée en abordant
des notions nécessaires à ceux qui entendent pratiquer en
autonomie puisque :
-
la toxicité des gaz leur imposera des règles
de sécurité et de prévention des accidents,
-
la dissolution des gaz leur fixera des règles de décompression,
-
la différence de milieu modifiera leurs perceptions
sensorielles, qu’elles soient visuelles ou auditives.
Nous nous en tiendrons à la même orientation
que celle du premier cours de physique : il ne s’agit toujours pas de faire
un cours de physique théorique qui n’apporterait rien au plongeur.
Notre approche est donc résolument tournée vers la pratique
et vers la compréhension des phénomènes concrets.
Les puristes auront la bonté de nous pardonner…
Retour
au sommaire
1. Toxicité
des gaz
Contrairement à ce que croient certains profanes,
nous savons tous qu’à de rares exceptions près, la majorité
des plongeurs respirent de l’air, lors d’une plongée loisir classique.
Nous verrons dans ce chapitre que tous les gaz deviennent toxiques à
une pression donnée. Il est donc important de connaître la
nature et les effets de ces gaz sur le plongeur afin d’éviter tout
effet indésirable et/ou dangereux.
1.1. Rappels
Composition de l'air
-
79 % d'azote (N2)
-
20,9 % d'oxygène (O2)
-
0,03 % de gaz carbonique (CO2)
-
0,07 % de gaz rares
Loi de Mariotte
-
P x V = Cste
1.2. Expériences
1ère expérience
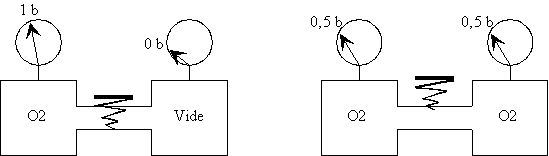
| Le récipient de gauche
contient de l'O2 à la pression de 1 bar
Le vide a été effectué dans le récipient
de droite |
A l'ouverture du robinet, l'O2
contenu
dans le récipient de gauche se propage dans celui de droite jusqu'à
obtenir de l'O2 à 0,5 bar dans les deux récipients. |
L'O2 a envahi tout l'espace qui
lui est offert entraînant une baisse de pression dans les deux récipients
P x V = Cste.
2ème expérience
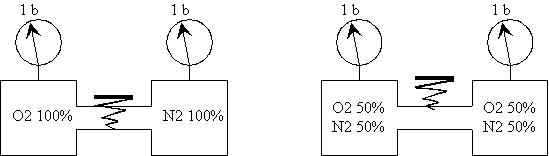
| Le récipient de gauche
contient de l'O2 à la pression de 1 bar
Celui de droite contient du N2 à 1 bar. |
A l'ouverture du robinet la pression
dans les 2 récipients reste à 1 bar mais ils contiennent
chacun 50% d'O2 et 50% de N2. |
Les deux gaz à 50% de concentration ont une
pression totale de 1 bar.Chaque gaz fournit une pression de 0,5 bar.
La pression partielle d'un gaz
constituant un mélange est la pression qu'aurait ce gaz, s'il occupait
seul le volume total.
1.3. Enoncé de la
loi de Dalton
A température donnée, la pression absolue d'un
mélange gazeux est égale à la somme des pressions
partielles des gaz qui le composent.
Exemple de l’air
|
Pair = PpN2 + PpO2
+ PpCO2 + Ppgaz rares
|
La pression partielle d’un gaz dans un mélange
est égale au produit de la pression absolue par la concentration
de ce gaz.
1.4. Applications
Elaboration des tables de plongée.Plongée
aux mélanges (NITROX).Oxygénothérapie hyperbare.
1.5 Conséquences
Tous les gaz présents dans l’air sont toxiques
à une pression donnée. On peut ainsi citer les trois principaux
auxquels nous serons confrontés :
- CO2 : cause de l’essoufflement A partir de
: PpCO2 > 0,02 b
- N2 : cause de la narcose A partir de : PpN2
> 4b
- O2 : cause de l’hyperoxie A partir de : PpO2
> 1,6 b
En conclusion, il ressort que des limitations de pression,
donc de profondeur nous seront imposées par les effets toxiques
des gaz que nous respirons en plongée. Le non respect de ces limitations
pourra provoquer des accidents, dits " biochimiques ", qui seront traités
dans le chapitre " accidents ".
1.6. Exercices
Dans tous les exercices qui suivent, on considèrera
que l’air est un mélange composé de 80% de N2
et 20% d’O2.
-
Quelle est la pression partielle d’oxygène (PpO2)
à 30 mètres ?
-
0,6 bar
-
0,8 bar
-
1,2 bar
-
1,7 bar
-
Quelle est la pression partielle d’azote (PpN2)
à 30 mètres ?
-
0,8 bar
-
2,4 bar
-
3,2 bar
-
3,6 bar
-
A quelle profondeur a-t-on une pression partielle d’oxygène
(PpO2) de 1,7 bar ?
-
Pour quelle proportion N2 / O2 a-t-on
une pression partielle d’oxygène (PpO2) de 1,7 bar
à 40 mètres ?
-
57,5 % N2 / 42,5 % O2
-
66 % N2 / 34 % O2
-
60 % N2 / 40 % O2
Retour
au sommaire
2. Dissolution
des gaz
La dissolution est un phénomène physique
que nous rencontrons au quotidien. Il peut s’agir de la dissolution :
-
d'un solide dans un liquide (sucre dans le café),
-
d'un liquide dans un solide (eau sur une craie),
-
d'un gaz dans un liquide (boisson gazeuse).
Le cas le plus intéressant pour le plongeur est celui
du gaz dissous dans les liquides. Nous verrons, en effet, que l’azote que
nous respirons dans l’air aura tendance à se dissoudre dans l’eau
contenue dans notre corps (60% de notre poids, environ). La compréhension
de ce phénomène est nécessaire puisqu’il nous imposera
des règles de sécurité primordiales.
2.1. Rappels
Définition de la pression absolue : PABS
= PATM + PHYDRO
Définition de la pression partielle : Pp gaz
= PABS x %gaz
2.2. Expérience
Dissolution d'un gaz dans un liquide
Remplissons un récipient pour moitié d’eau
et pour moitié d’un gaz et fermons le par un couvercle étanche.
On définit la tension d’un gaz comme
étant la quantité de ce gaz dissous dans le liquide. Elle
est exprimée en bar.
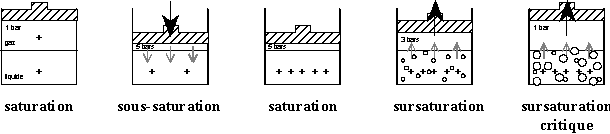
| .Rien n’a changé.
La seule pression exercée sur la liquide est la
PATM
T = P
|
On appuie sur le couvercle
La pression au dessus du liquide augmantant, le gaz commence
à se dissoudre dans le liquide
T < P
|
Au bout d’un certain temps, la
quantité de gaz dissous dans le liquide atteint sa valeur d’équilibre
T = P
|
On relâche légèrement
la pression exercée sur le couvercle. La quantité de gaz
dissous dans le liquide est libérée progressivement sous
forme de petites bulles
T > P
|
Si on relâche brutalement
la pression exercée sur le couvercle, la quantité de gaz
dissous dans le liquide est libérée brutalement sous forme
de grosses bulles.
T >> P
|
2.3. Enoncé de
la loi de Henry
A température constante, et à saturation,
la quantité de gaz dissous dans un liquide est proportionnelle à
la pression qu'exerce ce gaz sur le liquide.
2.4. Application à
la plongée
L’expérience précédente est directement
transposable à la réalité du plongeur, si l’on considère
que :
-
le corps humain est constitué de 60 à 65% d'eau
dont les cellules sont regroupées en tissus.
-
nous respirons un mélange gazeux (l’air) dont nous
consommons l’oxygène (O2) mais dont nous dissolvons l’azote
(N2) dans notre organisme.
Les différents états précédemment
décrits se retrouvent donc en plongée, comme indiqué
sur le schéma ci-dessous :
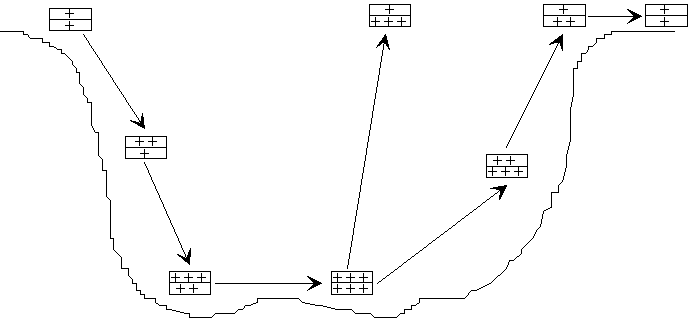
On dénombre un certain nombre de facteurs
favorisant la dissolution, parmi lesquels :
-
la pression
-
la température (dissolution ä
si T æ )
-
l'agitation - la durée
-
la surface d'échange
-
la nature du tissu
Les tables de plongée constituent l’application
la plus évidente de l’étude des mécanismes de dissolution
de l’azote dans le corps humain. Elles nous fourniront 3 informations essentielles
:
-
La courbe de sécurité, significative
des différents Sc,
-
La vitesse de remontée, significative de la
désaturation des tissus dont la période est courte (dits
tissus " courts "),
-
Les paliers, significatifs de la désaturation
des tissus dont la période est longue (dits tissus " longs ").
Informations complémentaires (hors programme)
L’azote étant, dans notre cas, le seul gaz de l’air
concerné par le mécanisme de dissolution, il conviendra de
considérer qu’à saturation, on a :
Les tissus du corps humain étant très nombreux,
on a choisi de les modéliser en compartiments. Chacun
d’entre eux est caractérisé par un coefficient de sursaturation
critique (Sc). Il est défini par le rapport :
On définit, enfin, deux notions relatives
aux mécanismes de dissolution :
le gradient : c’est la différence entre
la pression partielle du gaz à dissoudre et la quantité de
gaz dissous.
-
la période : elle représente,
pour un compartiment donné, le temps nécessaire pour dissoudre
(ou éliminer) la moitié du gradient. Autrement dit, elle
représente le temps nécessaire pour atteindre la demi-saturation.
2.5. Conséquences
La prévention des accidents de décompression
passe inévitablement par le respect des tables de plongée
à savoir :
-
respect de la vitesse de remontée (15 m/s),
-
respect des paliers éventuellement indiqués
dans la table.
Avoir compris les mécanismes de dissolution
des gaz, particulièrement celui de l’azote dans le corps humain
permet d’accepter les protocoles qu’elles nous imposent et de prendre conscience
de leur importance.
Retour
au sommaire
3. Notions
d’optique
3.1. Introduction
Lors de nos plongées, nous avons tous pu faire
l’expérience que notre vision était perturbée dans
l’eau :
-
nous voyons trouble sans masque,
-
les poissons ou objets paraissent plus gros, plus près
de nous, qu’ils ne sont en réalité,
-
certaines couleurs semblent disparaître avec la profondeur,
donnant une impression de " bleu ",
-
en eau trouble, la lampe n'éclaire pas,
-
etc…
Nous allons tenter d’expliquer le pourquoi de ces phénomènes.
En atteignant la surface de l'eau, puis en y pénétrant
les rayons lumineux sont soumis à 4 phénomènes principaux
: Réflexion, Réfraction, Absorption, Diffusion que
nous allons maintenant détailler.
3.2. Réflexion
et Réfraction
Chaque milieu (air, eau, diamant, etc…) est caractérisé
par son indice de réfraction, défini par :
où c est la célérité
de la lumière dans le vide (300000 km/s) et v la vitesse
de la lumière dans le milieu (v < c).
Quelques valeurs significatives de l’indice de réfraction
(ou indice optique) sont, par exemple :
-
pour l’air : 1,0003
-
pour l’eau : 1,33
-
pour le diamant : 2,4
Ces différences d’indices optiques conditionnent
la propagation d’un rayon lumineux d’un milieu à un autre. Par conséquent,
les perceptions visuelles du plongeur en seront modifiées selon
les schémas ci-dessous.
|
Oeil du plongeur
|
Poisson tel qu’on le voit
|
Poisson tel qu’il est en réalité
|
|
 |

|
En pratique, il faut retenir que, sous l’eau
:
|
distance apparente = distance réelle x
3/4
taille apparente = taille réelle x 4/3
|
Application à la plongée
-
rétrécissement du champ visuel à
environ 90° (nécessité du tour d'horizon, communication
visuelle)
-
mauvaise appréciation des distances (photo)
3.3. Absorption
A 10 m de profondeur, il n'y a déjà plus
que 33 % de la lumière du soleil.
Plus on descend en profondeur moins on voit de couleurs.
La couleur rouge est la première à disparaître à
10 mètres mais, vers 30 mètres, seuls restent le vert et
le bleu. On parle de disparition sélective des couleurs en fonction
de la profondeur.
Application à la plongée
-
nécessité d’un éclairage artificiel,
-
changement apparent de couleur de l’équipement (palmes,
stab, combinaison, etc…).
3.4. Diffusion
L'eau n'est pas homogène, elle contient des particules
en suspension, notamment au printemps lorsqu'elle est très chargée
en plancton. Un objet dans l'eau n'est pas éclairé par une
source lumineuse, mais par une multitude de sources secondaires arrivant
de toutes les directions.
Application à la plongée
-
visibilité réduite,
-
éclairage en eau trouble = phare dans le brouillard.
Retour
au sommaire
4. Notions
d’acoustique
4.1. Introduction
Le fait d’évoluer dans l’eau constitue un changement
important par rapport à l’air auquel notre audition est habituée.
Cela modifiera un certain nombre de nos repères et le plongeur devra
en tenir compte pour rester en sécurité.
4.2. Définitions
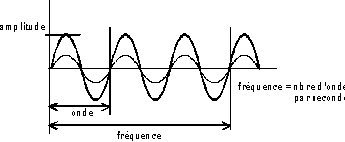
Un son est caractérisé par :
-
sa fréquence : Exprimée
en Hertz (Hz), c'est le nombre d'ondes par seconde. L'oreille humaine perçoit
les fréquences comprises entre 20Hz (graves) et 20 000 Hz (aiguës).
Le spectre de réception de l'oreille peut être déterminé
par un audiogramme.
-
son intensité : Exprimée en décibel
(dB), c'est l'amplitude de la vibration de la source.
-
son timbre : Il est lié à la
complexité de l'onde sonore.
4.3. Vitesse du son
Dans l'air, les molécules se propagent tous
azimuts.
-
Vitesse du son = 330 m/s.
Dans l'eau, les molécules se touchent
et glissent les unes par rapport aux autres.
-
Vitesse du son = 1530 m/s.
Dans un solide, les molécules sont figées
et le son est transmis intégralement (rail, tuyauterie...)
-
Vitesse du son = 5600 m/s.
4.4. Applications
Du fait de la meilleure propagation des ondes sonores
dans l’eau, on peut mieux entendre certains bruits :
-
chocs sur bouteilles
-
bruit dans l'embout et de certains animaux (langoustes)
-
pétard de rappel
Mais… Cette propagation plus rapide que celle à
laquelle nous sommes habitués n’est pas toujours un avantage. Ainsi,
le repérage de la direction d’origine des bruits (moteur de bateaux,
par exemple) devient impossible sous l’eau. Le tour d’horizon est donc
d’autant plus nécessaire.
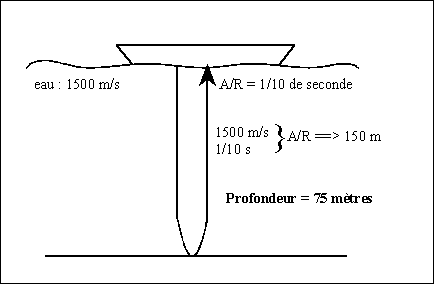
Citons, enfin, une dernière application, fort utile
: le sondeur. Son principe est décrit ci-dessous.
Retour
au sommaire
Conclusion
Voilà !
Nous avons fait le tour des principales bases de physique
nécessaires au plongeur autonome. Il doit être réellement
conscient de la nécessité d’une parfaite compréhension
des contraintes inhérentes au milieu dans lequel il sera appelé
à évoluer, puisqu’il en va de sa sécurité :
-
un plongeur ne peut ignorer qu’il évolue dans un environnement
où la pression intervient en permanence,
-
la compressibilité des gaz lui imposera des règles
de sécurité. De leur respect dépendra la prévention
des barotraumatismes,
-
les notions de flottabilité lui permettront d’adopter
un lestage adéquat, afin d’être capable de ne pas se fatiguer
inutilement (donc de prévenir l’essoufflement), d’améliorer
son confort et de tenir un éventuel palier,
-
la toxicité des gaz lui imposera des règles
de sécurité et de prévention d’accidents biochimiques,
-
la dissolution des gaz lui fixera des règles de décompression
(vitesse de remontée et paliers), à respecter pour éviter
les accidents biochimiques,
-
la différence de milieu modifiera ses perceptions
sensorielles, qu’elles soient visuelles ou auditives.
La prévention des accidents et l’utilisation des tables
feront l’objet de cours ultérieurs. Tous deux s’appuieront sur les
principes que vous avez vus ici, et sur le cours d’anatomie / physiologie
qui constituera votre prochaine séance.
Alors, bonne continuation !
Retour
au sommaire
Retour
au programme
Dernière mise à jour : 15 aoùt
2000
Copyright JM. Lasserre - F. Loubère 2000 -
Tous droits réservés